Подходы к формированию проекта Национальной лекарственной политики. Часть 3
Часть 3
Оценка потребностей в необходимых объемах финансирования и номенклатуре лекарственных препаратов для системы лекарственного обеспечения в амбулаторных условиях на ближайшие 2–5 лет
Для достижения цели по снижению смертности населения РФ и соответственно увеличения ОПЖ с нынешних 73 до 78 лет к 2024 г. по опыту развитых стран известно, что значительный эффект в этом отношении был достигнут за счет внедрения системы всеобщего лекарственного обеспечения. Эта система позволяет сделать современные лекарства доступными для всех граждан в амбулаторных условиях [2–5]. Надо помнить, что лекарство (таблетка) – это основной инструмент врача. Существенный прогресс в лечении болезней системы кровообращения, пищеварения, инфекционной патологии, злокачественных новообразований был сделан именно благодаря доступности современных ЛП. Например, в Великобритании смертность от болезней системы кровообращения (БСК) с 1981 по 2000 г. снизилась в 2 раза, причем на 21% это было связано с медицинскими вмешательствами, и бо́льшая часть этого медицинского эффекта была обеспечена за счет лекарств в амбулаторных условиях [12].
Важно, что в рамках национального проекта «Здравоохранение» существенное увеличение расходов на лекарства предусмотрено для онкологических заболеваний. Однако без увеличения доступности препаратов в амбулаторных условиях для лечения болезней системы кровообращения, инфекционных заболеваний, лечения детей и подростков существенного прорыва в увеличении продолжительности жизни к 2024 г. до 78 лет не сделать.
На основе проведенного нами анализа1 можно сделать вывод, что для увеличения доступности лекарств и тем самым снижения смертности, заболеваемости и инвалидности наших граждан дополнительно к 233 млрд руб., которые сегодня тратит государство из бюджетов всех уровней, потребуется еще 330 млрд руб. ежегодно (233 × 2,4 – 233). Тогда государственные расходы на лекарственное обеспечение в амбулаторных условиях в РФ увеличатся в 2,4 раза и достигнут уровня «новых» стран ЕС сегодня. Основным источником этих расходов должен стать федеральный бюджет, потому что сегодня наши граждане и так покрывают более 80% всех расходов на лекарства в амбулаторных условиях (в «новых» странах ЕС меньше – 60%).
В результате в России эти расходы ложатся серьезным бременем на бюджеты семей, тем более в условиях стагнации реальных денежных доходов населения. Дополнительные средства должны быть заложены на лекарственное обеспечение тех граждан, кто сегодня не имеет льгот, т.е. на систему всеобщего лекарственного обеспечения. При этом, конечно, те, кто имеет сегодня льготы, должны сохранить их в полном объеме. Далее встает вопрос, на лечение каких заболеваний и каких категорий населения в первую очередь должны быть направлены эти дополнительные средства.
Нами предложено 3 направления – БСК, инфекционные болезни и болезни детей от 3 до 17 лет. Это связано с тем, что данные заболевания лечатся и предотвращаются преимущественно методами медикаментозной терапии и вакцинами. Причем высокий эффект по снижению смертности можно получить в молодых возрастах, что будет способствовать ускорению темпов роста ОПЖ. Разница между показателями смертности от этих основных причин и возрастов в России и «новых-8» странах ЕС, близких к России по уровню экономического развития, представлена в табл. 1.
Таблица 1. Показатели смертности в России и «новых-8» странах ЕС (за последний возможный год)
_.png)
Эксперты далее должны ответить на вопрос, как распределить дополнительные средства между данными группами заболеваний. Для этого могут применяться следующие подходы: по вкладу в смертность и заболеваемость, по потребности (расчеты стоимости лечения), экспертно (консенсус специалистов).
Эти расчеты и обсуждения необходимо будет сделать в рамках разработки проекта НЛП. Следующим шагом необходимо решить, по каким именно нозологиям будет предоставляться бесплатное лечение и какой перечень лекарств из уже утвержденного перечня ЖНВЛП будет использоваться. При выборе нозологий и перечней лекарств необходимо учитывать критерии выбора – динамика снижения смертности и эффективность (т.е. достижение цели за минимально возможные средства). Иначе говоря, предпочтение будет отдаваться тем ЛП, которые позволят быстрее снизить смертность и за меньшие средства.
При расчетах требуемых объемов ЛП по определенной нозологии, как правило, используется несколько методов:
1) анализ объемов фактических объемов потребления;
2) анализ заболеваемости по данной нозологии;
3) анализ «стандартного» потребления и перенос на целевую группу;
4) анализ стоимости среднего дня лечения в различных условиях.
Для определения необходимых объемов лекарственных препаратов при выделении дополнительных средств чаще всего используется комбинация второго и третьего методов с различными поправками. Упрощенно показатели для определения объемов по методу заболеваемости представлены в табл. 2.
Таблица 2. Критерии и показатели для оценки необходимых объемов закупки лекарственных препаратов (ЛП) в амбулаторных условиях для граждан, не получающих ЛП в рамках государственных программ (льгот)
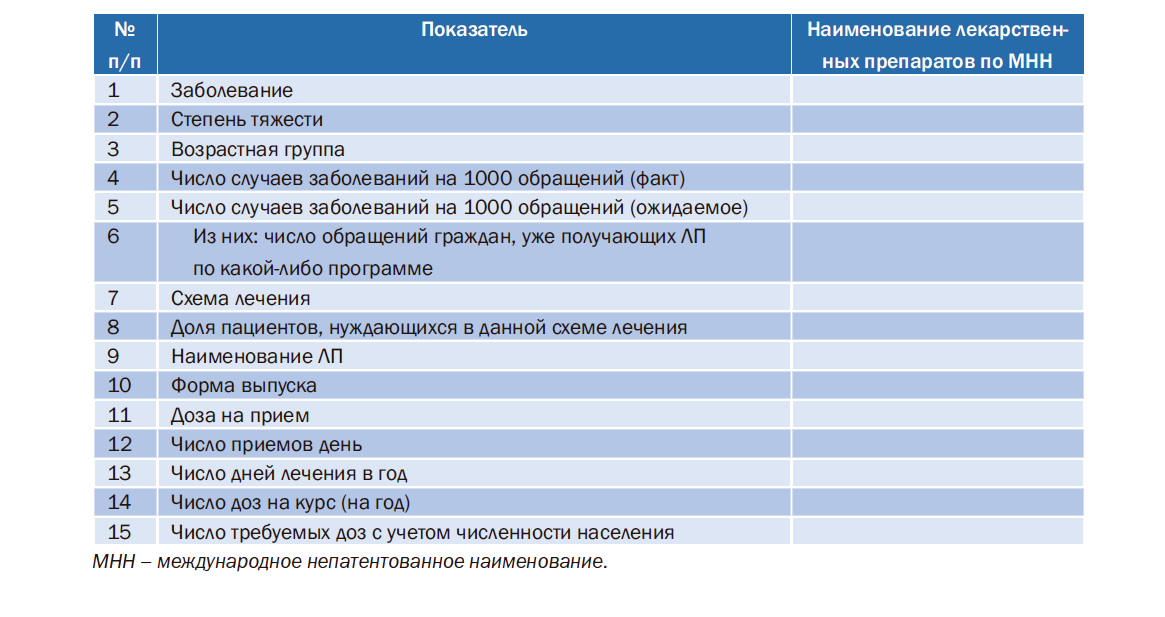
При определении объемов потребления ЛП по методу сравнения со стандартом можно проводить выборочные исследования или использовать данные других стран и затем с определенными поправками экстраполировать полученные данные на выбранную популяцию.
Для сравнения объемов потребления ЛП с другими странами используется показатель – стандартные дневные дозы (СДД) [6]. Ниже представлено описание порядка расчета потребления ЛП через СДД. Этот способ в свою очередь требует использования анатомо-терапевтическо-химической классификации. Анатомо-терапевтическо-химическая классификация (АТХ), или АТС (Anatomical Therapeutic Chemical Classification System), ранжируется по 5 уровням.
На 1-м уровне имеется 14 главных анатомических/фармакологических групп ЛС, например для метформина это группа ЛП для лечения «болезней пищеварительного тракта и обмена веществ». Каждая группа подразделяется на фармакологическую или терапевтическую подгруппу (2-й уровень), для метформина – это подгруппа «ЛП для лечения диабета».
На 3-м и 4-м уровне ЛС подразделяются на фармакологические (или терапевтические) и химические подгруппы, для метформина – это «ЛП, снижающие уровень глюкозы в крови, кроме инсулина» и «бигуаниды» соответственно.
На 5-м уровне дается химическая субстанция – «метформин». Стандартная (определенная) дневная доза (CДД) или DDD (Defined Daily Dose) – это средняя дневная доза ЛП, используемая по опреде- ленным показаниям у взрослых. Только одна СДД может соответствовать АТХ-коду и пути назначения (например, перорально). Она определяется экспертно для международного непатентованного наименования (МНН), например для аспирина перорально это 3г (для применения при болевом синдроме). СДД в привязке к АТХ-кодам публикуются ежегодно на сайте ВОЗ – WHOCC [7] и обновляется не реже 1 раза в 3 года.
CДД необязательно совпадает со средней реально назначаемой и средней реально потребляемой дозами ЛП. Названные дозы зависят от индивидуальных характеристик пациентов: тяжести заболевания, пола, возраста, фармакокинетики ЛП, приверженности пациента к лечению и др. Показатели для измерения СДД рассчитываются с учетом численности населения или пациенто-дней (койко-дней) в стационаре.
В амбулаторных условиях для длительных курсов терапии CДД измеряют в расчете на 1000 населения (жителей) в день. Например, 10 СДД на 1000 населения в день означает, что в этой группе населения в среднем ежедневно потребляется 10 СДД данного ЛП, или 1% населения (10/1000) потребляет этот ЛП ежедневно (в год проведения исследования). Для кратких курсов терапии в амбулаторных условиях CДД обычно измеряют в расчете на 1 человека (жителя) в год. Например, 5 СДД на 1 жителя в год может означать, что каждый житель проходил лечение в год как минимум 5 дней.
В стационарных условиях используют показатель СДД на 100 пациенто-дней (койко-дней). Например, 100 СДД антибиотика (при курсе 5 дней) на 100 койко-дней может означать, что 20 пациентов принимали по 1 СДД в течение 5 дней. Или 70 СДД снотворного ЛП на 100 койко-дней означает, что 70% пациентов принимали 1 СДД ежедневно. СДД может быть выражена также через CДД на одного пациента. Этот показатель выражает интенсивность лечения в группе пациентов, принимающих ЛП в определенный период времени. Если фактическая доза ЛП эквивалентна установленному CДД, этот показатель может отражать число дней лечения за определенный период. Данные для расчета СДД получают путем выборочного изучения выписанных рецептов, проданных упаковок, опросов медицинского персонала и пациентов.
Наиболее точным является учет СДД по данным, полученным из электронных историй болезней и амбулаторных карт. Для этого важно, чтобы число СДД было промаркировано на каждой упаковке ЛП. Потребление ЛП, выраженное через СДД, дает общее представление о потреблении ЛП вне зависимости от цен, валютной разницы, упаковки ЛП. Цель описанного метода – определить рациональность использования ЛП путем проведения сопоставимых сравнений потребления отдельных ЛП между популяциями пациентов в динамике, в различных регионах и странах.
Следует отметить, что использовать ценовые показатели для сравнения объемов потребления отдельных ЛП в динамике и между странами затруднительно из-за различий в ценах, колебаний валютного курса, такие сравнения используются только для общих объемов потребления ЛП. Объемные показатели (г, л и др.) можно использовать только для строго определенных отдельных лекарств, но не их групп с одинаковыми по силе активными ингредиентами.
По этой же причине ограничено использование показателя числа потребленных таблеток. Сравнение числа выписанных рецептов показательно только в том случае, когда одновременно учитывается число ЛП на рецепт или нужно определить частоту их выписки. В России актуальные данные по потреблению отдельных ЛП, рассчитанные методом АТХ/СДД, проводятся мало (есть только данные по потреблению антибиотиков за 2015 г. [9]).
В странах Организации экономического сотрудничества и развития (ОЭСР) такой учет ведется на постоянной основе. Для примера ниже представлена структура потребления антигипертензивных ЛП в странах ОЭСР (рис. 1) и антибиотиков с учетом данных по РФ (рис. 2). Объем потребления антигипертензивных ЛП включает ЛП по 5 АТХС2-категориям, которые назначаются при артериальной гипертензии: антигипертензивные, диуретики, β-блокаторы, блокаторы кальциевых каналов и ЛП, влияющие на ренинангиотензивную систему. Представленные данные говорят о том, что необходимы дальнейшие научные исследования, которые позволят оценить потребность населения в ЛП, по отдельным ЛП, по группам ЛП и нозологиям.
Рисунок 1. Потребление (стандартные дневные дозы, СДД) антигипертензивных лекарственных препаратов в странах Европейского союза (ЕС)
%20антигипертензивных%20ЛП%20в%20странах%20ЕС.png)
Рисунок 2. Потребление (стандартные дневные дозы, СДД) антибиотиков (выписанных) в Российской Федерации и странах Европейского союза (ЕС)
%20антибиотиков%20(выписанных)%20в%20РФ%20и%20ЕС.png)
Оценка потребностей в необходимых объемах финансирования для разработки новых лекарств в Российской Федерации на перспективу 10 лет
Мировой фармацевтический рынок, несмотря на то что во всех развитых странах происходит жесткое регулирование цен на ЛП, все равно будет расти. Так, по прогнозам Torreya [10, 11], к 2030 г. он вырастет в 1,6 раза в реальных ценах. При этом китайский фармацевтический рынок к 2030 г. вырастет в 2 раза. Именно поэтому многие крупные фармкомпании и инвесторы начали ориентироваться на разработку ЛП, направленных на лечение заболеваний, характерных для Китая.
Сегодня ряд крупных фармацевтических компаний охотно вкладывают средства в научно-исследовательские и опытно-конструкторские работы (НИОКР), направленные на лечение редких заболеваний. Это во многом происходит в результате государственной политики поддержки закупки таких ЛП и прорывов в исследовании генома человека. Следует также отметить, что в последние годы меняется бизнес-модель в разработке и производстве новых лекарств.
Если раньше весь жизненный цикл от разработки, производства и продажи лекарства обеспечивала одна крупная фармацевтическая компания, то сейчас в этом процессе принимают участие разные участники – вузы и НИИ (финансируемые за счет государственных средств), фонды развития, кластеры биотехнологических компаний, инвесторы и др.
Типовой жизненный цикл создания нового лекарства по ключевым этапам представлен на рис. 3 [12–15]. На нем также приведены доли распределения средств и время, затрачиваемое на разработку, по каждому этапу, а также вероятность перехода к следующему этапу. Следует отметить, что в последние годы имеет место тенденция к ускорению и удешевлению НИОКР (особенно первых этапов) в разработке новых лекарств благодаря использованию больших баз данных и искусственного интеллекта. Это позволяет анализировать не только модель «одно лекарство – одна мишень – одна болезнь», но и переходить к анализу комплексных моделей «несколько лекарств – несколько мишеней – несколько болезней».
Рисунок 3. Этапы создания нового лекарства

Для оценки потребностей в необходимых ресурсах для разработки инновационных лекарств в РФ экспертам необходимо последовательно ответить на 3 главных вопроса: 1. Какие направления в разработке новых лекарств важны для РФ?
2. Что возможно разработать в РФ и в какие сроки?
3. Какие ресурсы и система управления для этого необходимы?
Для справки, здесь и далее под новым лекарством мы понимаем инновационный ЛП. Формального определения понятия «инновационный ЛП» не существует. Однако в документах ОЭСР за 2018 г. [12] дано следующее его определение: «ЛП может называться инновационным, если он содержит новые активные вещества для лечения основных (значимых) заболеваний и состояний, для которых ранее не существовало эффективного воздействия или оно было недостаточным, который позволяет получить больший терапевтический эффект (или большую эффективность, или меньшую токсичность, или и то, и другое вместе) или другой превосходящий эффект (например, улучшение качества жизни пациента и его удобства) по сравнению с существующими терапевтическими альтернативами.
Лекарственный препарат, который является новым, но предполагает дополнительные преимущества по сравнению с имеющимися терапевтическими альтернативами, не может рассматриваться как инновационный».
“А medicine may be described as innovative if it: meets a previously unmet or inadequately met, substantive (i.e. non-trivial) health need, offers enhanced effectiveness (e.g. greater efficacy, reduced toxicity or both) or other incremental benefit (e.g. a substantive improvement in patient convenience) relative to existing therapeutic alternatives. Conversely, a product that is new or novel, but does not offer additional benefit over existing therapies would not per se be considered innovative”.
Для ответа на первый вопрос необходимо кратко представить основные направления инноваций в разработке новых лекарств:
- модернизация производства пептидов – энзимный синтез позволит существенно увеличить разработку и производство пептидных ЛП;
- применение противовоспалительных ЛП (канакинумаб) в предотвращении БСК и онкологических заболеваний;
- разработка ЛП на основе нуклеиновых кислот;
- разработка ЛП, корректирующих геном;
- клеточная терапия (СAR-T и др.); комбинация ЛП с медицинскими изделиями – имплантаты и электронные стимуляторы (биоэлектроника, искусственная поджелудочная железа).
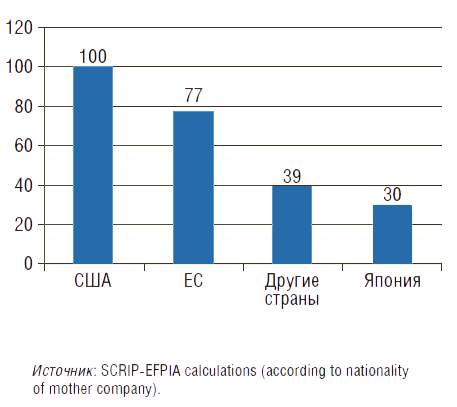
Что касается бизнеса, главным критерием является возврат инвестиций. Этот возврат в свою очередь определяется объемом рынка (внутреннего и внешнего) и/или наличием государственных стимулов для разработки, например, гарантированной ценой закупки. Далее важно определить, сколько новых ЛП реально произвести в РФ. Для этого оценим, сколько новых ЛП зарегистрировано в развитых странах за последние 5 лет (рис. 4). Видно, что в США за 5 лет зарегистрировано 100 новых ЛП. Тогда как в РФ за ближайшие 5 лет возможно зарегистрировать в 5 раз меньше – 20 новых ЛП (именно на столько меньше ВВП РФ, чем ВВП США в абсолютных величинах по ППС доллару – 3,7 и 19,4 трлн долл. по ППС соответственно). Тогда за 10 лет в РФ можно произвести 30–40 новых ЛП.
Рисунок 4. Число новых зарегистрированных лекарственных препаратов (ЛП) за 2013–2017 гг. в разных странах
Оценим, сколько для этого потребуется финансовых ресурсов. Стоимость НИОКР для разработки одного зарегистрированного ЛП в среднем за 10–12 лет составляет 2,6 млрд долл. [12, 16], или 65 млрд руб. по курсу доллара ППС (1 $ППС = 25 руб.). Другими словами, чтобы получить 30 новых лекарств за 10 лет, в России потребуется около 200 млрд руб. ежегодно (65 млрд руб. × 30 ЛП ÷ 10 лет).
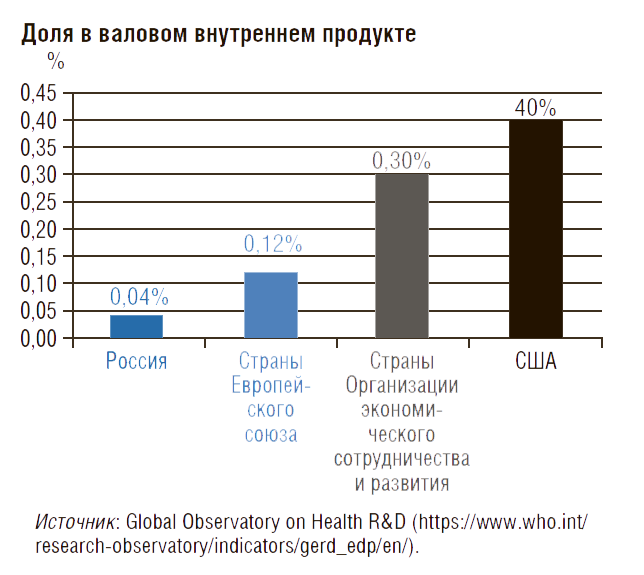
Таким образом, в РФ для разработки 30 новых ЛП за 10 лет потребуется вкладывать не менее 200 млрд руб. ежегодно. Можно оценить необходимые расходы на ЛП другим способом. Сегодня расходы на НИОКР (в области здоровья человека) государства и бизнеса в России в 8–10 раз меньше, чем в остальных странах, соответственно 0,04 и 0,3– 0,4% ВВП (рис. 5). Если увеличить расходы на НИОКР в РФ хотя бы до 0,3% ВВП, потребуется около 280 млрд руб. в год [92,1 трлн руб. (ВВП 2017 г.) × 0,3%]. В развитых странах государство обычно покрывает 1/3 или 1/2 всех расходов на НИОКР по разработке новых лекарств [12–15].
Рисунок 5. Расходы на научно-исследовательские и опытно-конструкторские работы в области здоровья человека в разных странах
Ежегодные государственные инвестиции для разработки 30 новых лекарств за 10 лет должны составить от 100 до 150 млрд руб. ежегодно в постоянных ценах (2017г.). Это, конечно, при условии, что остальные средства вложит бизнес (фармкомпании и инвесторы).
Следующий вопрос, на который необходимо ответить: что из запланированных НИОКР возможно реализовать в РФ? Для этого необходимо провести ревизию того, что было сделано в РФ за последние 10 лет, а именно – сколько и в каких НИИ были получены патенты, сколько зарегистрировано новых ЛП, сколько средств государственных и бизнеса было на это потрачено, какие компетенции имеются у отечественных вузов и НИИ. Далее потребуется определить, на что именно должны пойти дополнительные средства и в каких долях.
Например, какой объем средств необходим для подготовки и оплаты труда необходимых кадровых ресурсов, какие это кадры, какие потребуются информационные базы данных, программное обеспечение, лабораторное оборудование, каковы возможности кооперации внутри страны и с зарубежными коллегами (с кем), какая дополнительная регуляторная база необходима. Кроме того, необходимо будет создать благоприятную среду для реализации НИОКР.
Для ранних доклинических исследований важно наличие НИИ с мировым уровнем, высококвалифицированного персонала (обучающийся в стране или привлеченный), кластеры инновационных компаний, занимающиеся вопросами скрининга и анализа последовательности генома, партнерства с разными НИИ и стимулирующая регуляторная среда.
Для расширения объемов клинических исследований (КИ) необходимы система поддержки составления дизайна КИ, мотивация участников для включения в КИ, передовые медицинские вузы, квалифицированные специалисты для проведения исследований, система управления и контроля КИ. И наконец, необходимо определить, какая организация будет управлять достижением поставленных целей в части реализации национальной лекарственной политики.
Напомним, это - снижение смертности и увеличение ОПЖ до 78 лет к 2024 г., создание независимости РФ в части производства ЛП и разработка 30 инновационных ЛП за 10 лет. Из вышеприведенного анализа в частях 2 и 3 очевидно следует, что эта организационная структура должна быть не в каком-либо одном ведомстве, например Минпромторге России, Минздраве России или Минобрнауки России, это должна быть государственная корпорация, которая сможет, с одной стороны, квалифицированно способствовать достижению поставленных государственных целей РФ, с другой – гарантировать инвесторам возврат вложенных средств.
СВЕДЕНИЯ ОБ АВТОРАХ
Улумбекова Гузель Эрнстовна (Ulumbekova Guzel E.) – доктор медицинских наук, диплом MBA Гарвардского университета (Бостон, США), руководитель Высшей школы организации и управления здравоохранением – Комплексного медицинского консалтинга (ВШОУЗ–КМК), председатель правления Ассоциации медицинских обществ по качеству медицинской помощи и медицинского образования (АСМОК), доцент кафедры общественного здоровья и здравоохранения, экономики здравоохранения педиатрического факультета ФГБОУ ВО «Российский национальный исследовательский медицинский университет им. Н.И. Пирогова» Минздрава России, Москва, Россия
Калашникова Александра Владимировна (Кalashnikova Aleksandra V.) – научный сотрудник Научно-исследовательского центра Высшей школы организации и управления здравоохранением – Комплексного медицинского консалтинга (ВШОУЗ–КМК), Москва, Россия
Ахметова Гузель Марсовна (Akhmetova Guzel M.) – ассистент кафедры стоматологии детского возраста ФГБОУ ВО «Казанский государственный медицинский университет» Минздрава России, Казань, Россия
[1] Hoebert J.M., Dijk L., Mantel-Teeuwisse A.K., et al. National medicines policies – a review of the evolution and development processes. J Pharm Policy Pract. July 2013. 10.1186/2052-3211-6-55.
[2] Eaddy M.T., Cook C.L. How patient cost-sharing trends affect adherence and outcomes: a literature review. Pharm Ther. 2012; 37 (1): 45–55.
[3] Kesselheim A.S., Huybrechts K.F., Ranabhat CL., Atkinson J. Prescription drug insurance coverage and patient health outcomes: a systematic review. Am J Public Health. 2015; 105 (2): 17–30.
[4] Park M.-B., Kim C.-B., Jakovljevic M. The infl uence of universal health coverage on life expectancy at birth (LEAB) and healthy life expectancy (HALE): a multi-country cross-sectional. Front Pharmacol. 2018; 9: 1–10.
[5] Universal health coverage and health outcomes. In: OECD Final Report. Paris, 2016:
[6] Guidelines for ATC classifi cation and DDD assignment 2019. Norway: WHO Collaborating Centre for Drug Statistics Methodology, 2018:
[7] WHO Collaborating Centre for Drug Statistics Methodology.
[8] WHO Drug Information. URL:
[9] WHO report on surveillance of antibiotic consumption: 2016–2018 early implementation. Geneva: World Health Organization, 2018: 27–8.
[10] The future of the global pharmaceutical industry. Torreya. October, 2017
[11] Trends in the pharmaceutical industry. Arthur D Little. January, 2016
[12] Pharmaceutical innovation and access to medicines. In: OECD Health Policy Studies. Paris, 2018: 192 p.
[13] The pharmaceutical industry and global health: facts and fi gures 2015. International Federation of Pharmaceutical Manufacturers and Associations (IFPMA). November, 2015
[14] The pharmaceutical industry and global health: facts and fi gures 2017. International Federation of Pharmaceutical Manufacturers and Associations (IFPMA). February, 2017
[15] The pharmaceutical industry in fi gures: key data 2018. European Federation of Pharmaceutical Industries and Associations (EFPIA). 2018
[16] DiMasi J.A., Grabowski H.G., Hansen R.W. Innovation in the pharmaceutical industry: new estimates of R&D costs. J Health Econ. 2016; 47: 20–33
[17] Ba-alawi W., Soufan O., Essack M., Kalnis P., et al. DASPfi nd: new effi cient method to predict drug–target interactions. J. Cheminform. 2016; 8: 15. biomedcentral.com/articles/10.1186/s13321-016-0128-4.
[18] Candan G., Taşkin M.F., Yazgan H.R. Demand forecasting in pharmaceutical industry using artifi cial intelligence: neuro-fuzzy approach. J Military Inform Sci. 2014; 2 (2): 41–9
[19] Cook A.G. Forecasting for the pharmaceutical industry. In: The Second Edition of an Essential Business Planner’s Library. June, 2015. .
[20] Ghousi R., Mehrani S., Momeni M., Anjomshoaa S. Application of data mining techniques in drug consumption forecasting to help pharmaceutical industry production planning. In: International Conference on Industrial Engineering and Operations Management. July, 2012.
[21] Global Observatory on Health R&D.
[22] Quantifying pharmaceutical requirements. In: Management Sciences for Health. 2012. Ch. 20
[23] Ramana K.V., Xavier J.R., Sharma R.K. Recent trends in pharmaceutical biotechnology. Pharm Biotechnol Curr Res. 2017; 1 (1): 5
[24] Torjesen I. Drug development: the journey of a medicine from lab to shelf. Pharm J. 2015 May.
 Высшая школа организации и управления здравоохранением
Высшая школа организации и управления здравоохранением