Применение алгоритмов искусственного интеллекта для оценки эффективности терапии, назначаемой диализным пациентам
31 июля 2021
Автор: Черненко О.В., Лакман И.А., Шкель О.А., Падукова А.А., Нафиков Ш.Р., Шабанова К.И.
Оборотной стороной общей тенденции увеличения ожидаемой продолжительности жизни в экономически развитых странах стало увеличение доли населения, «дожившего» до терминальной стадии почечной недостаточности, требующей проведения диализной терапии на постоянной основе.
Согласно последним опубликованным данным Общероссийского регистра заместительной почечной терапии Российского диализного общества, на 31.12.2018 в России заместительную почечную терапию (ЗПТ) получали 54 953 больных с терминальной стадией хронической почечной недостаточности (ХПН). Темп прироста больных в 2018 г. по отношению к 2017 г. составил 15,7%, это самый большой прирост в истории регистрации больных на ЗПТ. Показатель распространенности, т.е. количество обеспеченных ЗПТ больных в пересчете на 1 млн населения, на 31.12.2017 в среднем по России вырос до 374 больных/млн, т.е. с 2015 г. показатель вырос практически на четверть (на 24%). В большинстве регионов за время работы регистра прослеживается отчетливая тенденция к развитию ЗПТ [1].
В соответствии с повышением доступности и качества оказания медицинских услуг уход за пациентами с терминальной стадией почечной недостаточности должен стать более персонализированным. Суть персонализированного лечебного процесса заключается в учете потребностей и предпочтений пациента, в оценке прогрессирования заболевания в анамнезе, в ответе на лечение и переносимости диализной терапии. Одним из решений для реализации персонализированных стратегий лечения диализных больных является внедрение информационных систем, основа которых – предиктивные модули с использованием технологий искусственного интеллекта, позволяющих поддерживать клинические решения врачей [2, 3].
Основой построения алгоритмов искусственного интеллекта, позволяющих корректно предсказать исход терапии, является качественная информация, собранная в достаточном объеме. На сегодняшний день существует реестр MONDO [4], включающий данные о более чем 200 тыс. диализных больных. Недостатком данного реестра является отсутствие возможности отслеживать в ретроспективе полную историю назначений, связанных и с процедурой гемодиализа, и с достижением целевых показателей эффективности сопутствующей терапии, например, по уровню гемоглобина, показателям фосфорно-кальциевого обмена (ФКО), гормона паращитовидной железы и другим результатам лабораторно-клинических и функциональных обследований диализного пациента.
На сегодняшний день существуют исследования, посвященные применению методов искусственного интеллекта (ИИ), в том числе алгоритмов машинного обучения в нефрологии, в частности при проведении диализа. Однако практически все они носят частный характер и не рассматривают проблему качества жизни диализных больных в целом. Актуальный обзор данной проблемы представлен М. Hueso и соавт. [5]. Инструменты ИИ в области диализа, в частности основанные на применении алгоритмов машинного обучения, преимущественно используются для подбора противоанемической терапии (ААТ), сопутствующей при лечении ХПН. Такой интерес к оценке и возможности прогнозирования эффективности ААТ не случаен, так как врачу для ее корректного назначения требуется учитывать слишком много различных факторов, в том числе прослеживаемых в динамике [6], и с этой задачей вполне может справляться ИИ, предварительно качественно обученный на достаточном количестве прецедентов эффективного лечения. Существует исследование, описывающее применение технологий ИИ для прогнозирования последствий, связанных с анемией, возникающей при проведении гемодиализа [7]. В исследовании J.M. Martinez-Martinez строятся модели прогнозирования значения гемоглобина (Hb) на основе алгоритмов, обученных на базе данных европейских пациентов, находящихся на гемодиализе [8]. Исследователи для прогнозирования уровня гемоглобина использовали различные инструменты ИИ: регрессионные линейные модели, искусственные нейронные сети (ANN), машины опорных векторов (SVM) и деревья решений. Все алгоритмы дали примерно одинаковые результаты. Здесь следует отметить, что все алгоритмы, применяемые авторами в данном исследовании, склонны к переобучению, что является существенным недостатком при внедрении подобных алгоритмов в реальных условиях, особенно в случае мониторинга эффективности терапии. На отечественном рынке информационных систем, поддерживающих решения врачей диализных пациентов, существует система управления лечебно-диагностическим процессом Maximus. В системе существует модуль предиктивного анализа, позволяющий прогнозировать вероятность наступления осложнений от диализных процедур [9].
Еще одним грозным осложнением долговременного применения диализной терапии является нарушение ФКО у больных с ХПН в терминальной стадии, которое без соответствующего лечения может привести к летальному исходу [10]. Здесь, так же как и при назначении ААТ, для адекватной терапии по восстановлению ФКО следует учитывать множество данных как о самом пациенте, так и о прошлом лечении. Однако исследований, посвященных применению средств ИИ к решению подобной проблемы, существенно меньше.
Таким образом, существующие на сегодняшний день программные продукты в виде интеллектуальных систем поддержки принятия решений, основанные на алгоритмах машинного обучения, имеют минимальный функционал и решают узконаправленные задачи. Практически во всех исследованиях отсутствуют такие предикторы, как способ введения препаратов, однако отсутствие учета данной информации может сильно исказить прогноз эффективности назначаемой терапии диализному пациенту.
Целью настоящего исследования является формирование методологических основ разработки медицинской информационной системы, позволяющей комплексно рассматривать проблемы качества жизни диализных больных с помощью алгоритмов машинного обучения. Конкретной практической задачей является разработка интеллектуальной системы поддержки принятия решений для назначения персонализированной лекарственной терапии пациентам с ХПН на основе их профиля, а также оценки эффективности стратегии лечения с точки зрения валидности назначений по восстановлению ФКО и ААТ. Под профилем пациента понимается совокупность его социально-демографических характеристик, функциональных обследований, лабораторно-клинических исследований, отслеживаемых в динамике, «истории» фармакологических назначений в связке «препарат–доза–способ введения».
Таким образом, для достижения поставленной цели крайне важны методология и инструменты сбора и разметки данных, а также качество и количество данных о пациенте. Вот почему интеллектуальный модуль системы поддержки принятия решения врачом-нефрологом не отделим от медицинской информационной системы диализного центра. В настоящем исследовании в качестве медицинской системы для сбора данных использовалась специализированная медицинская ERP-система для диализных центров ООО «Лаборатория гемодиализа», разработанная ООО «Лексема». Для получения данных о результатах лабораторных исследований высокого качества в оперативном режиме данная система была интегрирована с информационной системой лаборатории «Инвитро». Все эти методы построения информационной системы диализного центра позволили получить большой объем данных (данные около 2000 регистрационных карт пациентов) высокого качества (достоверных и без пропусков) для обучения интеллектуальных моделей.
Основой для разработки точных с точки зрения предсказания алгоритмов машинного обучения является корректно сформированная размеченная выборка достаточного объема. В настоящем исследовании для разметки данных с точки зрения эффективности и неэффективности терапии, а также неэффективности по причине недостижения целевых показателей и избыточности используемой терапии в случае ее отнесения к неэффективной, используются базы знаний на основе экспертного опроса врачей-нефрологов. Согласованность мнений экспертов относительно отнесения терапии к эффективной/неэффективной по причине недостижения целевых показателей/избыточной проверяется на основе расчета критериев Макнемара, где мнения экспертов считаются согласованными при отклонении нулевой гипотезы об
отсутствии согласованности при р<0,05.
Для упрощения разметки данных об эффективности/неэффективности или избыточности/неэффективности по причине недостижения целевых показателей терапии используются формы интерфейсов, встроенные непосредственно в ERP-систему для гемодиализа. Модель оценки эффективности терапии строилась по принципу воронки: на 1-м этапе терапия классифицировалась на эффективную или неэффективную, на 2-м этапе неэффективная терапия классифицировалась на неэффективную по причине недостижения целевых показателей и избыточную. Одной из проблем качественного обучения алгоритмов машинного обучения является несбалансированность по классам в обучающих выборках (в рассматриваемом случае это относится к разделению неэффективной и избыточной терапии). Для решения этой проблемы и получения достоверных результатов при большом количестве признаков требуется применение технологии сэмплирования. Под сэмплированием понимается методика преобразования выборки, позволяющая изменить количество различных образцов в обучающей выборке для получения сбалансированности классов, необходимой для улучшения результатов классификации. В рассматриваемой задаче использовались 2 метода сэмплирования: SMOTE и random oversampling [11].
Суть алгоритма random oversampling заключается в определении на 1-м этапе количества недостающих образцов положительного или отрицательного класса, для того чтобы выборка была сбалансированной. На 2-м этапе проводится размножение меньшего класса примеров, до тех пор, пока новая выборка не станет сбалансированной. Алгоритм сэмплирования SMOTE основан на создании новых образцов, которые «похожи» на объекты из класса с меньшей размерностью. Для решения рассматриваемой задачи для создания нового примера находится расстояние между признаками «соседних» примеров, с использованием правила ближайшего соседа. Полученное расстояние умножается на коэффициент из (0, 1), при этом получается новое расстояние, добавляемое к признакам образца из меньшего класса. В результате получается набор новых образцов из меньшего класса, но с новыми незначительно измененными признаками.
Для сокращения признакового пространства используется метод главных компонент [12], который позволяет учесть больше признаков без потери точности алгоритмов предсказания эффективности/неэффективности видов терапии. В качестве методов оценки эффективности или избыточности проведения ААТ и терапии по восстановлению ФКО используются алгоритмы машинного обучения, такие как экстремальный градиентный бустинг над деревьями решений и логистической регрессией, а также алгоритм случайного леса [13]. Преимуществом технологии бустинга, в отличие от технологии нейронных сетей, является практически отсутствие склонности к переобучению и, как следствие, лучшая адаптируемость под новые данные, что принципиально важно в случае использования предлагаемого решения для пациентов с различными популяционными характеристиками. Для достижения точности построенных моделей используются процедуры кросс-валидации с подбором оптимального числа фолдов и «слепая» валидация [14], заключающаяся в обучении алгоритмов машинного обучения на 70% выборки и тестирование результатов на 30%. В качестве метрик качества классификации используются метрики, рассчитанные на основе матрицы сопряженности, в которой определены верно классифицированные эффективные терапии TP (True Positives), верно отнесенные к неэффективным терапии TN (True Negatives), FN (False Negatives) – эффективная терапия, отнесенная алгоритмом к неэффективной терапии и FP (False Positives) – неэффективная терапия, классифицированная как эффективная. На основании этих значений рассчитываются соотношения:
где Se – специфичность модели (корректное угадывание неэффективной терапии и избыточной); чувствительность Sp – корректное угадывание эффективной и недостаточной терапии.
В качестве метрики, учитывающей специфичность и чувствительность, используется F-мера, определяемая из соотношения:
Еще одной метрикой качества, позволяющей оценить точность модели классификации, считается мера Accuracy, определяемая по формуле:
Также оценивается метрика AUC (площадь под ROC-кривой) как общий показатель качества классификации. Так как задача классификации решается для медицинских задач, приемлемым качеством считается достижение специфичности и чувствительности алгоритмов свыше 98%, F-мера свыше 0,95, AUC свыше 0,95. Принципиальной новизной предлагаемого подхода в части оценки эффективности терапии по причине достижения целевых показателей (или значимой положительной динамики) анализа крови, в отличие от рассмотренных выше, является возможность выявления причин неэффективности назначаемого лечения (неэффективность как по причине недостижения целевых показателей, так и избыточности терапии), на основе учета большего количества признаков профиля пациента, в том числе качественных характеристик (например, наличие сопутствующих заболеваний). Для подбора наиболее подходящей пациенту с данным профилем терапии и характеристик процедуры диализа используется алгоритм мэтчинга. Для оценки качества подобранной стратегии лечения рассчитывалась доля соответствия профиля больному, у которого данная стратегия лечения привела к эффективному результату. Приемлемой считалась доля в 80%. Соответствие искалось по базе прецедентов, составленной из более чем 9000 значений в виде соответствия между профилем пациента, назначенной ему терапии в виде препарата, дозы и способа введения, и эффективностью терапии с точки зрения достижимости целевых показателей или наличия положительной динамики. Авторами исследования алгоритм мэтчинга был адаптирован за счет учета всех параметров по поиску наибольшего соответствия с весами, которые были проставлены в ходе экспертного опроса врачей-нефрологов, и в результате многократного тестирования предложенных методов. В результате используется алгоритм смешанного типа, учитывающий результаты мэтчинга и ограничения на переносимость конкретных препаратов каждым пациентом. Таким образом достигается нахождение оптимальной стратегии лечения пациента с учетом его индивидуальных особенностей.
Следует отметить, что подходы, методы и способы интеграции с любыми устройствами, лежащие в основании разработки предлагаемой системы, позволяют легко адаптировать ее под другие бизнес-процессы по предоставлению комплексного диализного лечения, будь то домашний диализ или мобильная искусственная почка.
На 1-м этапе исследования были сформированы правила для проведения разметки относительно эффективности и неэффективности, а также неэффективности по причине недостижения целевых показателей или избыточности терапии против анемии и по восстановлению ФКО на основе экспертного опроса врачей-нефрологов. Таким образом была сформирована база знаний экспертных оценок врачей. Для достижения показателей высокой корректности оценок для разметки данных врачи опрашивались без возможности совещания, такой подход позволил практически исключить спорные вопросы по отнесению терапии к различным классам. Согласованность мнений была подтверждена критерием Макнемара (р=0,0002), что позволило сделать заключение о согласованности мнений. Для проверки полученной разметки были написаны аналитические формы в медицинской ERP-системе лаборатории диализа. В результате корректность размеченных данных проверялась независимо 2 экспертами-врачами, не задействованными в выработке правил относительно эффективности терапии, ошибки в разметке были менее 0,3%. Основным критерием эффективности терапии считалось достижение целевых показателей анализов крови пациентов. На этом этапе были внесены изменения в оценку эффективности терапии по восстановлению ФКО для пациентов, перенесших паратиреоидэктомию.
В результате сформировался полный пул параметров для обучения модели по размеченным данным для ААТ: пол и возраст пациента, индекс массы тела, наличие гепатита В и С, ВИЧ-инфекции, наличие или отсутствие назначения лекарственной терапии в прошлых периодах с указанием лекарственного средства (рекомбинантные эритропоэтины длинного и короткого действия, полимер аллиламина карбоната, препараты железа, антипаратиреоидные препараты, карбонат кальция, кальцимиметики, альфа D3 и др.), его дозировки, периодичности приема и способа введения, показатели на момент назначения терапии (гемоглобин, ферритин, калий, натрий, лейкоциты, гематокрит, тромбоциты, эритроциты, глюкоза, альбумин, креатинин, фосфор, мочевина, железо, паратгормон, кальций, холестерин, белок, процент насыщения трансферрина железом, витамин D, фосфатаза, бикарбонат плазмы), предшествующие значения гемоглобина, фертильность, длительность приема эритропоэтинов, прирост гемоглобина за 1 и 3 мес, длительность нахождения на диализном лечении, показатель эффективности диализной процедуры (среднемесячное значение соотношения KT/V). Полный пул параметров для терапии по восстановлению ФКО: пол пациента, возраст, индекс массы тела, наличие гепатита В и С, ВИЧ-инфекции, наличие или отсутствие назначения лекарственной терапии в прошлых периодах с указанием лекарственного средства (рекомбинантные эритропоэтины длинного и короткого действия, полимер аллиламина карбоната, препараты железа, антипаратиреоидные препараты, карбонат кальция, кальцимиметики, альфа D3 и др.), его дозировки, периодичности приема и способа введения, показатели на момент назначения терапии [гемоглобин, ферритин, калий, натрий, лейкоциты, гематокрит, тромбоциты, эритроциты, глюкоза, альбумин, креатинин, фосфор, мочевина, железо, паратгормон (ПТГ), кальций, холестерин, белок, процент насыщения трансферрина железом, витамин D, фосфатаза, бикарбонат плазмы], прошлое и позапрошлое значение ПТГ, два предшествующих значения кальция, прошлое значение, и позапрошлое значение фосфора, значение прироста ПТГ за 1–3 мес, значение прироста фосфора за 3 и 6 мес, значение прироста кальция за 1 и 3 мес. Дозировка препаратов бралась суммарная за весь месяц лечения, значения анализов – следующие после курса лечения на месяц. Также для записей о лечении анемии были введены искусственные параметры: критериальные – тип назначаемых препаратов эритропоэтинов (короткого или длительного действия); фертильность женщины (да или нет). Для сокращения признакового пространства признаки преобразовывались посредством SVD-разложения [21] и с помощью использования метода главных компонент.
На 2-м этапе проводили калибровку полученных размеченных данных. Для обучения моделей классификации (отнесения терапии к классу эффективная/неэффективная) для ААТ было получено 9158 записей, для терапии по восстановлению ФКО – 8928 записей. Выборки были сбалансированы по отношению к представлению каждого класса: к неэффективной терапии относилось для ФКО 45% записей, для ААТ – 61%. Для определения среди неэффективной терапии неэффективных по причине недостижения целевых показателей и избыточных имелось следующее представление классов соответственно: для ААТ – 22%, для ФКО – 8%. Для перехода к сбалансированным выборкам в этом случае использовался метод сэмплирования: в частности, процедуры oversampling и SMOTE. Таким образом, все обучающие выборки были сбалансированы, что значительно повысило надежность моделей предиктивной аналитики при разделении классов на неэффективную по причине недостижения целевых показателей и избыточную терапию.
На 3-м этапе проводили непосредственно обучение моделей, предсказывающих эффективность ААТ и терапии по восстановлению ФКО. Для достижения точности построенных моделей использовали «слепую» валидацию, заключающуюся в обучении алгоритмов машинного обучения на 70% выборки и тестировании результатов на 30%. В качестве алгоритмов машинного обучения использовали экстремальный градиентный бустинг над деревьями решений и логистической регрессией, алгоритмы случайного леса.
В результате на тестовой выборке были получены следующие метрики качества для оценки эффективности/неэффективности видов терапии: для противоанемической (алгоритм градиентный бустинг) чувствительность 98,9%, специфичность 98,2%, F=0,989, AUC=0,99; для терапии по восстановлению ФКО (алгоритм градиентный бустинг): чувствительность 98,4%, специфичность 98,3%, F=0,98, AUC=0,985. В результате на тестовой выборке были получены следующие метрики качества для оценки неэффективности по причине недостижения целевых показателей/избыточности терапии: для противоанемической (алгоритм случайный лес с random oversampling) чувствительность 98,4%, специфичность 97,7%, F=0,99, AUC=0,98; для терапии по восстановлению ФКО (алгоритм экстремальный бустинг с random oversampling): чувствительность 99,5%, специфичность 100%, F=0,997, AUC=0,995. На основании полученных метрик при «слепой» валидации можно сделать вывод об очень высокой предсказательной точности классификации терапий. Алгоритмы проходят тестирование на данных 24 диализных центров в следующих регионах: Башкортостан, Удмуртия, Ханты-Мансийский автономный округ – Югра (ХМАО).
На 4-м этапе для подбора наиболее подходящей пациенту с данным профилем терапии использовали алгоритм мэтчинга. Преимущество данного решения заключалось в том, что врачу представляли 3 стратегии лечения пациента с указанием вероятности его соответствия эффективности (свыше 80%) с оценкой стоимости каждого лечения на 1 мес применения.
На 5-м этапе была проведена интеграция всех алгоритмов классификации и соответствия (мэтчинга), реализованных на языке Python в ERP-систему, обслуживающую гемодиализные центры, программная реализация которой осуществлена на платформе для разработки веб-приложений Lexema средствами языков программирования JavaScript и Transact-SQL.
Одним из критериев качества для разработки любой медицинской информационной системы, позволяющей комплексно рассматривать проблемы качества жизни больных, является не только точность постановки диагноза, назначение действенного лечения и оценка риска осложнений, но и экономический эффект от внедрения подобного программного продукта.
Так, оперативный мониторинг эффективности терапии и построение рекомендательной системы, содержащей эффективные рекомендации, в данном исследовании, а также при последующем использовании его результатов позволит наиболее оптимально использовать средства, выделяемые на данную терапию.
Так, например, уже проведенная в рамках проекта оценка эффективности лечения пациентов на диализе за 2018 г. методами машинного обучения выявила существенный процент проведенного неэффективного лечения при высокой стоимости самой терапии для диализных пациентов, а именно – 48% неэффективной антианемической терапии и 46% неэффективной терапии по восстановлению ФКО. При достижении целевого показателя проекта – 95% точности оценки эффективности увеличение составит около 47% в среднем.
Данный пример показывает, что разработка интеллектуальной системы поддержки принятия решений для назначения персонализированной диализной и лекарственной терапии пациентам с ХПН, а также оценки эффективности стратегии лечения с точки зрения результативности самой процедуры гемодиализа, валидности назначений по восстановлению ФКО и ААТ на основе профиля пациента является актуальной задачей для диализных центров.
Алгоритмы проходят тестирование на данных 24 диализных центров в следующих регионах: Башкортостан, Удмуртия, ХМАО.
Значимость настоящего исследования заключается в универсальности предлагаемой методики по созданию интеллектуальной системы поддержки принятия решений для назначения персонализированной терапии.
Предлагаемая методика позволяет не только оценивать ранее проведенную лекарственную терапию, но и с высоким уровнем достоверности прогнозировать эффективность назначаемого лечения, что в значительной степени повышает качество оказываемой медицинской помощи. Повышение качества помощи происходит за счет возможности использовать лечащим врачом не только собственного опыта, но и доступа к опыту эффективного лечения всеми врачами ООО «Лаборатории гемодиализа».
E-mail: och@dializrb.ru
https://orcid.org/0000-0001-7907-806X
Лакман Ирина Александровна (Irina A. Lakman) – кандидат технических наук, доцент ФГБОУ ВО«УГАТУ», ведущий специалист по технологиям искусственного интеллекта ООО «Лексема», Уфа, Российская Федерация
E-mail: Lackmania@mail.ru
https://orcid.org/0000-0001-9876-9202
Шкель Оксана Александровна (Oksana A. Shkel) – заместитель директора по лечебной части ООО «Лаборатория гемодиализа», Уфа, Российская Федерация
E-mail: zamdir@dializrb.ru
https://orcid.org/0000-0003-2854-8927
Падукова Анастасия Анатольевна (Anastasia A. Padukova) – руководитель проектов ООО «Лексема», Уфа, Российская Федерация
E-mail: padukova@lexema.ru
https://orcid.org/0000-0002-3630-3084
Нафиков Шамиль Римович (Shamil R. Nafikov) – заведующий отделением гемодиализа ООО «Лаборатория гемодиализа», Уфа, Российская Федерация
E-mail: ufa@dializrb.ru
https://orcid.org/0000-0001-9938-0047
Шабанова Ксения Игоревна (Ksenia I. Shabanova) – магистр по специальности «Прикладная математика и информатика» ФГБОУ ВО «УГАТУ», специалист по анализу данных ООО «Лексема», Уфа, Российская Федерация
E-mail: shabanova_ki@lexema.ru
https://orcid.org/0000-0002-1925-3548
2. Usvyat L., Dalrymple L.S., Maddux F.W. Usingtechnology to inform and deliver precise personalized care to patients with end-stage kidney disease // Semin. Nephrol. 2018. Vol. 38, N 4. P. 418–425. DOI: https://doi.org/10.1016/j.semnephrol.2018.05.011
3. Hueso M., Vellido A. Artifi cial intelligence and dialysis// Kidney Dis. 2019. Vol. 5. P. 1–2.
DOI: https://doi.org/10.1159/000493933
4. Von Gersdorff G.D., Usvyat L., Marcelli D., GrassmannA., Marelli C., Etter M. et al. Monitoring dialysis outcomes across the world – the MONDO global database consortium // Blood Purif. 2014. Vol. 36, N 3–4. P. 165–172. DOI: https://doi.org/10.1159/000356088
5. Hueso M., Vellido A., Montero N., Barbieri C., Ramos R.,Angoso M. et al. Artifi cial intelligence for the artifi cial kidney: pointers to the future of a personalized hemodialysis therapy // Kidney Dis. 2018. Vol. 4. P. 1–9. DOI: https://doi.org/10.1159/000486394
6. Lankhorst C.E., Wish J.B. Anemia in renal disease: diagnosis and management // Blood Rev. 2010. Vol. 24. P. 39–47. DOI: https://doi.org/10.1016/j.blre.2009.09.001
7. Brier M.E., Gaweda A.E. Artifi cial intelligence for optimalanemia management in end-stage renal disease // Kidney Int. 2016. Vol. 90. P. 259–261. DOI: https://doi.org/10.1016/j.kint.2016.05.018
8. Martínez-Martínez J.M., Escandell-Montero P., BarbieriC., Soria-Olivas E., Mari F., Martinez Sober M. et al. Prediction of the hemoglobin level in hemodialysis patients using machine learning techniques // Comput. Methods Programs Biomed. 2014. Vol. 117. P. 208–217. DOI: https://doi.org/10.1016/j.cmpb.2014.07.001
9. Зиновьев Д.А., Новицкий В.О., Малкоч А.В. Применение нейросетевых методов машинного обучения в лечении осложнений у пациентов на гемодиализе // Врач и информационные технологии. 2019. № 2. С. 29–37.
10. Fukagawa M., Kido R., Komaba H., Onishi Y., YamaguchiT., Hasegawa T. et al. Abnormal mineral metabolism and mortality in hemodialysis patients with secondary hyperparathyroidism: evidence from marginal structural models used to adjust for time-dependent confounding // Am. J. Kidney Diseases. 2014. Vol. 63, N 6. P. 979–987. DOI: https://doi.org/10.1053/j.ajkd.2013.08.011
11. Chawla N., Bowyer K., Hall L., Kegelmeyer W.SMOTE: synthetic minority over-sampling technique // J. Artif. Intell. Res. 2002. Vol. 16. P. 341–378. DOI: https://doi.org/10.1613/jair.953
12. Cangelosi R., Goriely A. Component retention inprincipal component analysis with application to cDNA microarray data // Biol. Direct. 2007. Vol. 2. P. 2. DOI: https://doi.org/10.1186/1745-6150-2-2
13. Witten I.H., Frank E. Data Mining: Practical MachineLearning Tools and Techniques. 2nd ed. Morgan Kaufmann, 2005. 558 р.
14. Airola A., Pahikkala T., Waegeman W., De Baets B.,Salakoski T. An experimental comparison of cross-validation techniques for estimating the area under the ROC curve // Comput. Stat. Data Anal. 2011. Vol. 55, N 4. P. 1828–1844. DOI: https://doi.org/10.1016/j.csda.2010.11.018
15. Escandell-Montero P., Chermisi M., Martínez-MartínezJ.M., Gomez-Sanchis J., Barbieri C., Soria-Olivas E. et al. Optimization of anemia treatment in hemodialysis patients via reinforcement learning // Artif. Intell. Med. 2014. Vol. 62, N 1. P. 47–60. DOI: https://doi.org/10.1016/j.artmed.2014.07.004
16. Press W.H., Flannery B.P., Teukolsky S.A., VetterlingW.T. Singular value decomposition. § 2.6 // Numerical Recipes in FORTRAN: The Art of Scientifi c Computing. 2nd ed. Cambridge, England : Cambridge University Press, 1992. P. 51–63.
Согласно последним опубликованным данным Общероссийского регистра заместительной почечной терапии Российского диализного общества, на 31.12.2018 в России заместительную почечную терапию (ЗПТ) получали 54 953 больных с терминальной стадией хронической почечной недостаточности (ХПН). Темп прироста больных в 2018 г. по отношению к 2017 г. составил 15,7%, это самый большой прирост в истории регистрации больных на ЗПТ. Показатель распространенности, т.е. количество обеспеченных ЗПТ больных в пересчете на 1 млн населения, на 31.12.2017 в среднем по России вырос до 374 больных/млн, т.е. с 2015 г. показатель вырос практически на четверть (на 24%). В большинстве регионов за время работы регистра прослеживается отчетливая тенденция к развитию ЗПТ [1].
В соответствии с повышением доступности и качества оказания медицинских услуг уход за пациентами с терминальной стадией почечной недостаточности должен стать более персонализированным. Суть персонализированного лечебного процесса заключается в учете потребностей и предпочтений пациента, в оценке прогрессирования заболевания в анамнезе, в ответе на лечение и переносимости диализной терапии. Одним из решений для реализации персонализированных стратегий лечения диализных больных является внедрение информационных систем, основа которых – предиктивные модули с использованием технологий искусственного интеллекта, позволяющих поддерживать клинические решения врачей [2, 3].
Основой построения алгоритмов искусственного интеллекта, позволяющих корректно предсказать исход терапии, является качественная информация, собранная в достаточном объеме. На сегодняшний день существует реестр MONDO [4], включающий данные о более чем 200 тыс. диализных больных. Недостатком данного реестра является отсутствие возможности отслеживать в ретроспективе полную историю назначений, связанных и с процедурой гемодиализа, и с достижением целевых показателей эффективности сопутствующей терапии, например, по уровню гемоглобина, показателям фосфорно-кальциевого обмена (ФКО), гормона паращитовидной железы и другим результатам лабораторно-клинических и функциональных обследований диализного пациента.
На сегодняшний день существуют исследования, посвященные применению методов искусственного интеллекта (ИИ), в том числе алгоритмов машинного обучения в нефрологии, в частности при проведении диализа. Однако практически все они носят частный характер и не рассматривают проблему качества жизни диализных больных в целом. Актуальный обзор данной проблемы представлен М. Hueso и соавт. [5]. Инструменты ИИ в области диализа, в частности основанные на применении алгоритмов машинного обучения, преимущественно используются для подбора противоанемической терапии (ААТ), сопутствующей при лечении ХПН. Такой интерес к оценке и возможности прогнозирования эффективности ААТ не случаен, так как врачу для ее корректного назначения требуется учитывать слишком много различных факторов, в том числе прослеживаемых в динамике [6], и с этой задачей вполне может справляться ИИ, предварительно качественно обученный на достаточном количестве прецедентов эффективного лечения. Существует исследование, описывающее применение технологий ИИ для прогнозирования последствий, связанных с анемией, возникающей при проведении гемодиализа [7]. В исследовании J.M. Martinez-Martinez строятся модели прогнозирования значения гемоглобина (Hb) на основе алгоритмов, обученных на базе данных европейских пациентов, находящихся на гемодиализе [8]. Исследователи для прогнозирования уровня гемоглобина использовали различные инструменты ИИ: регрессионные линейные модели, искусственные нейронные сети (ANN), машины опорных векторов (SVM) и деревья решений. Все алгоритмы дали примерно одинаковые результаты. Здесь следует отметить, что все алгоритмы, применяемые авторами в данном исследовании, склонны к переобучению, что является существенным недостатком при внедрении подобных алгоритмов в реальных условиях, особенно в случае мониторинга эффективности терапии. На отечественном рынке информационных систем, поддерживающих решения врачей диализных пациентов, существует система управления лечебно-диагностическим процессом Maximus. В системе существует модуль предиктивного анализа, позволяющий прогнозировать вероятность наступления осложнений от диализных процедур [9].
Еще одним грозным осложнением долговременного применения диализной терапии является нарушение ФКО у больных с ХПН в терминальной стадии, которое без соответствующего лечения может привести к летальному исходу [10]. Здесь, так же как и при назначении ААТ, для адекватной терапии по восстановлению ФКО следует учитывать множество данных как о самом пациенте, так и о прошлом лечении. Однако исследований, посвященных применению средств ИИ к решению подобной проблемы, существенно меньше.
Таким образом, существующие на сегодняшний день программные продукты в виде интеллектуальных систем поддержки принятия решений, основанные на алгоритмах машинного обучения, имеют минимальный функционал и решают узконаправленные задачи. Практически во всех исследованиях отсутствуют такие предикторы, как способ введения препаратов, однако отсутствие учета данной информации может сильно исказить прогноз эффективности назначаемой терапии диализному пациенту.
Целью настоящего исследования является формирование методологических основ разработки медицинской информационной системы, позволяющей комплексно рассматривать проблемы качества жизни диализных больных с помощью алгоритмов машинного обучения. Конкретной практической задачей является разработка интеллектуальной системы поддержки принятия решений для назначения персонализированной лекарственной терапии пациентам с ХПН на основе их профиля, а также оценки эффективности стратегии лечения с точки зрения валидности назначений по восстановлению ФКО и ААТ. Под профилем пациента понимается совокупность его социально-демографических характеристик, функциональных обследований, лабораторно-клинических исследований, отслеживаемых в динамике, «истории» фармакологических назначений в связке «препарат–доза–способ введения».
Методология
Особенностью разработки систем поддержки принятия решений в медицине является требование к высокой точности и корректности предлагаемых решений, так как ценой ошибки являются человеческая жизнь и здоровье. При построении таких систем следует учитывать множество комбинаций переменных и причинно-следственных связей, относящихся как к профилю пациента, так и к характеристикам самого назначаемого лечения. Учесть все это человеку и описать в виде продукционных правил достаточно сложно, однако с такой задачей легко справляются алгоритмы машинного обучения как часть технологий ИИ. Единственным условием для получения высокой предсказательной точности на основе разрабатываемых алгоритмов машинного обучения является большое количество качественных данных.Таким образом, для достижения поставленной цели крайне важны методология и инструменты сбора и разметки данных, а также качество и количество данных о пациенте. Вот почему интеллектуальный модуль системы поддержки принятия решения врачом-нефрологом не отделим от медицинской информационной системы диализного центра. В настоящем исследовании в качестве медицинской системы для сбора данных использовалась специализированная медицинская ERP-система для диализных центров ООО «Лаборатория гемодиализа», разработанная ООО «Лексема». Для получения данных о результатах лабораторных исследований высокого качества в оперативном режиме данная система была интегрирована с информационной системой лаборатории «Инвитро». Все эти методы построения информационной системы диализного центра позволили получить большой объем данных (данные около 2000 регистрационных карт пациентов) высокого качества (достоверных и без пропусков) для обучения интеллектуальных моделей.
Основой для разработки точных с точки зрения предсказания алгоритмов машинного обучения является корректно сформированная размеченная выборка достаточного объема. В настоящем исследовании для разметки данных с точки зрения эффективности и неэффективности терапии, а также неэффективности по причине недостижения целевых показателей и избыточности используемой терапии в случае ее отнесения к неэффективной, используются базы знаний на основе экспертного опроса врачей-нефрологов. Согласованность мнений экспертов относительно отнесения терапии к эффективной/неэффективной по причине недостижения целевых показателей/избыточной проверяется на основе расчета критериев Макнемара, где мнения экспертов считаются согласованными при отклонении нулевой гипотезы об
отсутствии согласованности при р<0,05.
Для упрощения разметки данных об эффективности/неэффективности или избыточности/неэффективности по причине недостижения целевых показателей терапии используются формы интерфейсов, встроенные непосредственно в ERP-систему для гемодиализа. Модель оценки эффективности терапии строилась по принципу воронки: на 1-м этапе терапия классифицировалась на эффективную или неэффективную, на 2-м этапе неэффективная терапия классифицировалась на неэффективную по причине недостижения целевых показателей и избыточную. Одной из проблем качественного обучения алгоритмов машинного обучения является несбалансированность по классам в обучающих выборках (в рассматриваемом случае это относится к разделению неэффективной и избыточной терапии). Для решения этой проблемы и получения достоверных результатов при большом количестве признаков требуется применение технологии сэмплирования. Под сэмплированием понимается методика преобразования выборки, позволяющая изменить количество различных образцов в обучающей выборке для получения сбалансированности классов, необходимой для улучшения результатов классификации. В рассматриваемой задаче использовались 2 метода сэмплирования: SMOTE и random oversampling [11].
Суть алгоритма random oversampling заключается в определении на 1-м этапе количества недостающих образцов положительного или отрицательного класса, для того чтобы выборка была сбалансированной. На 2-м этапе проводится размножение меньшего класса примеров, до тех пор, пока новая выборка не станет сбалансированной. Алгоритм сэмплирования SMOTE основан на создании новых образцов, которые «похожи» на объекты из класса с меньшей размерностью. Для решения рассматриваемой задачи для создания нового примера находится расстояние между признаками «соседних» примеров, с использованием правила ближайшего соседа. Полученное расстояние умножается на коэффициент из (0, 1), при этом получается новое расстояние, добавляемое к признакам образца из меньшего класса. В результате получается набор новых образцов из меньшего класса, но с новыми незначительно измененными признаками.
Для сокращения признакового пространства используется метод главных компонент [12], который позволяет учесть больше признаков без потери точности алгоритмов предсказания эффективности/неэффективности видов терапии. В качестве методов оценки эффективности или избыточности проведения ААТ и терапии по восстановлению ФКО используются алгоритмы машинного обучения, такие как экстремальный градиентный бустинг над деревьями решений и логистической регрессией, а также алгоритм случайного леса [13]. Преимуществом технологии бустинга, в отличие от технологии нейронных сетей, является практически отсутствие склонности к переобучению и, как следствие, лучшая адаптируемость под новые данные, что принципиально важно в случае использования предлагаемого решения для пациентов с различными популяционными характеристиками. Для достижения точности построенных моделей используются процедуры кросс-валидации с подбором оптимального числа фолдов и «слепая» валидация [14], заключающаяся в обучении алгоритмов машинного обучения на 70% выборки и тестирование результатов на 30%. В качестве метрик качества классификации используются метрики, рассчитанные на основе матрицы сопряженности, в которой определены верно классифицированные эффективные терапии TP (True Positives), верно отнесенные к неэффективным терапии TN (True Negatives), FN (False Negatives) – эффективная терапия, отнесенная алгоритмом к неэффективной терапии и FP (False Positives) – неэффективная терапия, классифицированная как эффективная. На основании этих значений рассчитываются соотношения:
- Доля истинно эффективных терапий (TruePositives Rate):
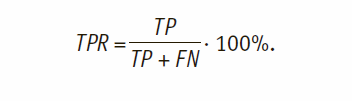
- Доля ложноэффективных терапий (False Positives Rate):

где Se – специфичность модели (корректное угадывание неэффективной терапии и избыточной); чувствительность Sp – корректное угадывание эффективной и недостаточной терапии.
В качестве метрики, учитывающей специфичность и чувствительность, используется F-мера, определяемая из соотношения:
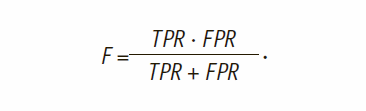
Еще одной метрикой качества, позволяющей оценить точность модели классификации, считается мера Accuracy, определяемая по формуле:
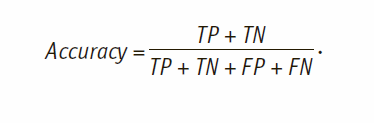
Также оценивается метрика AUC (площадь под ROC-кривой) как общий показатель качества классификации. Так как задача классификации решается для медицинских задач, приемлемым качеством считается достижение специфичности и чувствительности алгоритмов свыше 98%, F-мера свыше 0,95, AUC свыше 0,95. Принципиальной новизной предлагаемого подхода в части оценки эффективности терапии по причине достижения целевых показателей (или значимой положительной динамики) анализа крови, в отличие от рассмотренных выше, является возможность выявления причин неэффективности назначаемого лечения (неэффективность как по причине недостижения целевых показателей, так и избыточности терапии), на основе учета большего количества признаков профиля пациента, в том числе качественных характеристик (например, наличие сопутствующих заболеваний). Для подбора наиболее подходящей пациенту с данным профилем терапии и характеристик процедуры диализа используется алгоритм мэтчинга. Для оценки качества подобранной стратегии лечения рассчитывалась доля соответствия профиля больному, у которого данная стратегия лечения привела к эффективному результату. Приемлемой считалась доля в 80%. Соответствие искалось по базе прецедентов, составленной из более чем 9000 значений в виде соответствия между профилем пациента, назначенной ему терапии в виде препарата, дозы и способа введения, и эффективностью терапии с точки зрения достижимости целевых показателей или наличия положительной динамики. Авторами исследования алгоритм мэтчинга был адаптирован за счет учета всех параметров по поиску наибольшего соответствия с весами, которые были проставлены в ходе экспертного опроса врачей-нефрологов, и в результате многократного тестирования предложенных методов. В результате используется алгоритм смешанного типа, учитывающий результаты мэтчинга и ограничения на переносимость конкретных препаратов каждым пациентом. Таким образом достигается нахождение оптимальной стратегии лечения пациента с учетом его индивидуальных особенностей.
Следует отметить, что подходы, методы и способы интеграции с любыми устройствами, лежащие в основании разработки предлагаемой системы, позволяют легко адаптировать ее под другие бизнес-процессы по предоставлению комплексного диализного лечения, будь то домашний диализ или мобильная искусственная почка.
Результаты
На основании предложенной методологии исследования были пройдены следующие этапы для достижения поставленной цели.На 1-м этапе исследования были сформированы правила для проведения разметки относительно эффективности и неэффективности, а также неэффективности по причине недостижения целевых показателей или избыточности терапии против анемии и по восстановлению ФКО на основе экспертного опроса врачей-нефрологов. Таким образом была сформирована база знаний экспертных оценок врачей. Для достижения показателей высокой корректности оценок для разметки данных врачи опрашивались без возможности совещания, такой подход позволил практически исключить спорные вопросы по отнесению терапии к различным классам. Согласованность мнений была подтверждена критерием Макнемара (р=0,0002), что позволило сделать заключение о согласованности мнений. Для проверки полученной разметки были написаны аналитические формы в медицинской ERP-системе лаборатории диализа. В результате корректность размеченных данных проверялась независимо 2 экспертами-врачами, не задействованными в выработке правил относительно эффективности терапии, ошибки в разметке были менее 0,3%. Основным критерием эффективности терапии считалось достижение целевых показателей анализов крови пациентов. На этом этапе были внесены изменения в оценку эффективности терапии по восстановлению ФКО для пациентов, перенесших паратиреоидэктомию.
В результате сформировался полный пул параметров для обучения модели по размеченным данным для ААТ: пол и возраст пациента, индекс массы тела, наличие гепатита В и С, ВИЧ-инфекции, наличие или отсутствие назначения лекарственной терапии в прошлых периодах с указанием лекарственного средства (рекомбинантные эритропоэтины длинного и короткого действия, полимер аллиламина карбоната, препараты железа, антипаратиреоидные препараты, карбонат кальция, кальцимиметики, альфа D3 и др.), его дозировки, периодичности приема и способа введения, показатели на момент назначения терапии (гемоглобин, ферритин, калий, натрий, лейкоциты, гематокрит, тромбоциты, эритроциты, глюкоза, альбумин, креатинин, фосфор, мочевина, железо, паратгормон, кальций, холестерин, белок, процент насыщения трансферрина железом, витамин D, фосфатаза, бикарбонат плазмы), предшествующие значения гемоглобина, фертильность, длительность приема эритропоэтинов, прирост гемоглобина за 1 и 3 мес, длительность нахождения на диализном лечении, показатель эффективности диализной процедуры (среднемесячное значение соотношения KT/V). Полный пул параметров для терапии по восстановлению ФКО: пол пациента, возраст, индекс массы тела, наличие гепатита В и С, ВИЧ-инфекции, наличие или отсутствие назначения лекарственной терапии в прошлых периодах с указанием лекарственного средства (рекомбинантные эритропоэтины длинного и короткого действия, полимер аллиламина карбоната, препараты железа, антипаратиреоидные препараты, карбонат кальция, кальцимиметики, альфа D3 и др.), его дозировки, периодичности приема и способа введения, показатели на момент назначения терапии [гемоглобин, ферритин, калий, натрий, лейкоциты, гематокрит, тромбоциты, эритроциты, глюкоза, альбумин, креатинин, фосфор, мочевина, железо, паратгормон (ПТГ), кальций, холестерин, белок, процент насыщения трансферрина железом, витамин D, фосфатаза, бикарбонат плазмы], прошлое и позапрошлое значение ПТГ, два предшествующих значения кальция, прошлое значение, и позапрошлое значение фосфора, значение прироста ПТГ за 1–3 мес, значение прироста фосфора за 3 и 6 мес, значение прироста кальция за 1 и 3 мес. Дозировка препаратов бралась суммарная за весь месяц лечения, значения анализов – следующие после курса лечения на месяц. Также для записей о лечении анемии были введены искусственные параметры: критериальные – тип назначаемых препаратов эритропоэтинов (короткого или длительного действия); фертильность женщины (да или нет). Для сокращения признакового пространства признаки преобразовывались посредством SVD-разложения [21] и с помощью использования метода главных компонент.
На 2-м этапе проводили калибровку полученных размеченных данных. Для обучения моделей классификации (отнесения терапии к классу эффективная/неэффективная) для ААТ было получено 9158 записей, для терапии по восстановлению ФКО – 8928 записей. Выборки были сбалансированы по отношению к представлению каждого класса: к неэффективной терапии относилось для ФКО 45% записей, для ААТ – 61%. Для определения среди неэффективной терапии неэффективных по причине недостижения целевых показателей и избыточных имелось следующее представление классов соответственно: для ААТ – 22%, для ФКО – 8%. Для перехода к сбалансированным выборкам в этом случае использовался метод сэмплирования: в частности, процедуры oversampling и SMOTE. Таким образом, все обучающие выборки были сбалансированы, что значительно повысило надежность моделей предиктивной аналитики при разделении классов на неэффективную по причине недостижения целевых показателей и избыточную терапию.
На 3-м этапе проводили непосредственно обучение моделей, предсказывающих эффективность ААТ и терапии по восстановлению ФКО. Для достижения точности построенных моделей использовали «слепую» валидацию, заключающуюся в обучении алгоритмов машинного обучения на 70% выборки и тестировании результатов на 30%. В качестве алгоритмов машинного обучения использовали экстремальный градиентный бустинг над деревьями решений и логистической регрессией, алгоритмы случайного леса.
В результате на тестовой выборке были получены следующие метрики качества для оценки эффективности/неэффективности видов терапии: для противоанемической (алгоритм градиентный бустинг) чувствительность 98,9%, специфичность 98,2%, F=0,989, AUC=0,99; для терапии по восстановлению ФКО (алгоритм градиентный бустинг): чувствительность 98,4%, специфичность 98,3%, F=0,98, AUC=0,985. В результате на тестовой выборке были получены следующие метрики качества для оценки неэффективности по причине недостижения целевых показателей/избыточности терапии: для противоанемической (алгоритм случайный лес с random oversampling) чувствительность 98,4%, специфичность 97,7%, F=0,99, AUC=0,98; для терапии по восстановлению ФКО (алгоритм экстремальный бустинг с random oversampling): чувствительность 99,5%, специфичность 100%, F=0,997, AUC=0,995. На основании полученных метрик при «слепой» валидации можно сделать вывод об очень высокой предсказательной точности классификации терапий. Алгоритмы проходят тестирование на данных 24 диализных центров в следующих регионах: Башкортостан, Удмуртия, Ханты-Мансийский автономный округ – Югра (ХМАО).
На 4-м этапе для подбора наиболее подходящей пациенту с данным профилем терапии использовали алгоритм мэтчинга. Преимущество данного решения заключалось в том, что врачу представляли 3 стратегии лечения пациента с указанием вероятности его соответствия эффективности (свыше 80%) с оценкой стоимости каждого лечения на 1 мес применения.
На 5-м этапе была проведена интеграция всех алгоритмов классификации и соответствия (мэтчинга), реализованных на языке Python в ERP-систему, обслуживающую гемодиализные центры, программная реализация которой осуществлена на платформе для разработки веб-приложений Lexema средствами языков программирования JavaScript и Transact-SQL.
Обсуждение
Полученные результаты обучения модели по оценке эффективности сопутствующих диализу терапии соответствуют ранее выполненным исследованиям других ученых. Так, например, в работе, выполненной коллективом лаборатории по интеллектуальному анализу данных Университета Валенсии совместно с научным центром Fresenius Medical Care [15] в 2009 г., лаг запаздывания для динамических переменных, который исследователи считают статистически оправданным, равен 6 мес. В настоящем проводимом исследовании для анализа эффективности ААТ учитываются прошлые результаты анализов на гемоглобин и ферритин в отсрочке за 3 мес, для анализа эффективности терапии по восстановлению ФКО учитываются анализы на паращитовидный гормон, содержание фосфора и кальция в крови в отсрочке за 6 мес. Следует также обратить внимание, что при обучении моделей и для оценки эффективности ААТ и терапии по восстановлению ФКО совместно учитывались текущие значения как показателей гемоглобина, ферритина и трансферрина (характерных при оценке ААТ), так и показателей ПТГ, кальция и фосфора (характерных при оценке терапии по восстановлению ФКО). Похожий подход использовали исследователи лаборатории по интеллектуальному анализу данных Университета Валенсии совместно с научным центром Fresenius Medical Care в работе [16] в 2014 г.: для оценки эффективности лечения эритропоэтинами анемии у диализных пациентов с помощью средств ИИ в обучении, помимо традиционных показателей (гемоглобин, ферритин и др.), также учитывался уровень фосфатов в крови.Одним из критериев качества для разработки любой медицинской информационной системы, позволяющей комплексно рассматривать проблемы качества жизни больных, является не только точность постановки диагноза, назначение действенного лечения и оценка риска осложнений, но и экономический эффект от внедрения подобного программного продукта.
Так, оперативный мониторинг эффективности терапии и построение рекомендательной системы, содержащей эффективные рекомендации, в данном исследовании, а также при последующем использовании его результатов позволит наиболее оптимально использовать средства, выделяемые на данную терапию.
Так, например, уже проведенная в рамках проекта оценка эффективности лечения пациентов на диализе за 2018 г. методами машинного обучения выявила существенный процент проведенного неэффективного лечения при высокой стоимости самой терапии для диализных пациентов, а именно – 48% неэффективной антианемической терапии и 46% неэффективной терапии по восстановлению ФКО. При достижении целевого показателя проекта – 95% точности оценки эффективности увеличение составит около 47% в среднем.
Данный пример показывает, что разработка интеллектуальной системы поддержки принятия решений для назначения персонализированной диализной и лекарственной терапии пациентам с ХПН, а также оценки эффективности стратегии лечения с точки зрения результативности самой процедуры гемодиализа, валидности назначений по восстановлению ФКО и ААТ на основе профиля пациента является актуальной задачей для диализных центров.
Алгоритмы проходят тестирование на данных 24 диализных центров в следующих регионах: Башкортостан, Удмуртия, ХМАО.
Заключение
На сегодняшний день благодаря использованию современных аппаратов для проведения диализных процедур и автоматическому считыванию информации с аппаратов-анализаторов крови собирается достаточно большое количество информации, сбор которой в структурированном виде можно осуществлять с помощью специализированных медицинских информационных систем. На основании собранной информации можно осуществлять предиктивный анализ, помогающий врачу в принятии решения относительно назначения эффективного лечения. Представленная в статье методика разработки интеллектуальной системы поддержки принятия решений позволяет назначать персонализированную лекарственную терапию пациентам с ХПН, а также оценить достаточно точно (до 98%) эффективность предложенной стратегии лечения.Значимость настоящего исследования заключается в универсальности предлагаемой методики по созданию интеллектуальной системы поддержки принятия решений для назначения персонализированной терапии.
Предлагаемая методика позволяет не только оценивать ранее проведенную лекарственную терапию, но и с высоким уровнем достоверности прогнозировать эффективность назначаемого лечения, что в значительной степени повышает качество оказываемой медицинской помощи. Повышение качества помощи происходит за счет возможности использовать лечащим врачом не только собственного опыта, но и доступа к опыту эффективного лечения всеми врачами ООО «Лаборатории гемодиализа».
СВЕДЕНИЯ ОБ АВТОРАХ
Черненко Олег Валерианович (Oleg V. Chernenko) – кандидат медицинских наук, заместитель директора ООО «Лаборатория гемодиализа», Уфа, Российская ФедерацияE-mail: och@dializrb.ru
https://orcid.org/0000-0001-7907-806X
Лакман Ирина Александровна (Irina A. Lakman) – кандидат технических наук, доцент ФГБОУ ВО«УГАТУ», ведущий специалист по технологиям искусственного интеллекта ООО «Лексема», Уфа, Российская Федерация
E-mail: Lackmania@mail.ru
https://orcid.org/0000-0001-9876-9202
Шкель Оксана Александровна (Oksana A. Shkel) – заместитель директора по лечебной части ООО «Лаборатория гемодиализа», Уфа, Российская Федерация
E-mail: zamdir@dializrb.ru
https://orcid.org/0000-0003-2854-8927
Падукова Анастасия Анатольевна (Anastasia A. Padukova) – руководитель проектов ООО «Лексема», Уфа, Российская Федерация
E-mail: padukova@lexema.ru
https://orcid.org/0000-0002-3630-3084
Нафиков Шамиль Римович (Shamil R. Nafikov) – заведующий отделением гемодиализа ООО «Лаборатория гемодиализа», Уфа, Российская Федерация
E-mail: ufa@dializrb.ru
https://orcid.org/0000-0001-9938-0047
Шабанова Ксения Игоревна (Ksenia I. Shabanova) – магистр по специальности «Прикладная математика и информатика» ФГБОУ ВО «УГАТУ», специалист по анализу данных ООО «Лексема», Уфа, Российская Федерация
E-mail: shabanova_ki@lexema.ru
https://orcid.org/0000-0002-1925-3548
Литература
1. Андрусев А.М., Перегудова Н.Г., Шинкарев М.Б.,Томилина Н.А. Заместительная терапия терминальной хронической почечной недостаточности в Российской Федерации в 2014–2018 гг. Краткий отчет по данным Российского регистра заместительной почечной терапии. 19 с. URL: http://www.nephro.ru/content/files/registr/Registr_2014-2018_short.PDF2. Usvyat L., Dalrymple L.S., Maddux F.W. Usingtechnology to inform and deliver precise personalized care to patients with end-stage kidney disease // Semin. Nephrol. 2018. Vol. 38, N 4. P. 418–425. DOI: https://doi.org/10.1016/j.semnephrol.2018.05.011
3. Hueso M., Vellido A. Artifi cial intelligence and dialysis// Kidney Dis. 2019. Vol. 5. P. 1–2.
DOI: https://doi.org/10.1159/000493933
4. Von Gersdorff G.D., Usvyat L., Marcelli D., GrassmannA., Marelli C., Etter M. et al. Monitoring dialysis outcomes across the world – the MONDO global database consortium // Blood Purif. 2014. Vol. 36, N 3–4. P. 165–172. DOI: https://doi.org/10.1159/000356088
5. Hueso M., Vellido A., Montero N., Barbieri C., Ramos R.,Angoso M. et al. Artifi cial intelligence for the artifi cial kidney: pointers to the future of a personalized hemodialysis therapy // Kidney Dis. 2018. Vol. 4. P. 1–9. DOI: https://doi.org/10.1159/000486394
6. Lankhorst C.E., Wish J.B. Anemia in renal disease: diagnosis and management // Blood Rev. 2010. Vol. 24. P. 39–47. DOI: https://doi.org/10.1016/j.blre.2009.09.001
7. Brier M.E., Gaweda A.E. Artifi cial intelligence for optimalanemia management in end-stage renal disease // Kidney Int. 2016. Vol. 90. P. 259–261. DOI: https://doi.org/10.1016/j.kint.2016.05.018
8. Martínez-Martínez J.M., Escandell-Montero P., BarbieriC., Soria-Olivas E., Mari F., Martinez Sober M. et al. Prediction of the hemoglobin level in hemodialysis patients using machine learning techniques // Comput. Methods Programs Biomed. 2014. Vol. 117. P. 208–217. DOI: https://doi.org/10.1016/j.cmpb.2014.07.001
9. Зиновьев Д.А., Новицкий В.О., Малкоч А.В. Применение нейросетевых методов машинного обучения в лечении осложнений у пациентов на гемодиализе // Врач и информационные технологии. 2019. № 2. С. 29–37.
10. Fukagawa M., Kido R., Komaba H., Onishi Y., YamaguchiT., Hasegawa T. et al. Abnormal mineral metabolism and mortality in hemodialysis patients with secondary hyperparathyroidism: evidence from marginal structural models used to adjust for time-dependent confounding // Am. J. Kidney Diseases. 2014. Vol. 63, N 6. P. 979–987. DOI: https://doi.org/10.1053/j.ajkd.2013.08.011
11. Chawla N., Bowyer K., Hall L., Kegelmeyer W.SMOTE: synthetic minority over-sampling technique // J. Artif. Intell. Res. 2002. Vol. 16. P. 341–378. DOI: https://doi.org/10.1613/jair.953
12. Cangelosi R., Goriely A. Component retention inprincipal component analysis with application to cDNA microarray data // Biol. Direct. 2007. Vol. 2. P. 2. DOI: https://doi.org/10.1186/1745-6150-2-2
13. Witten I.H., Frank E. Data Mining: Practical MachineLearning Tools and Techniques. 2nd ed. Morgan Kaufmann, 2005. 558 р.
14. Airola A., Pahikkala T., Waegeman W., De Baets B.,Salakoski T. An experimental comparison of cross-validation techniques for estimating the area under the ROC curve // Comput. Stat. Data Anal. 2011. Vol. 55, N 4. P. 1828–1844. DOI: https://doi.org/10.1016/j.csda.2010.11.018
15. Escandell-Montero P., Chermisi M., Martínez-MartínezJ.M., Gomez-Sanchis J., Barbieri C., Soria-Olivas E. et al. Optimization of anemia treatment in hemodialysis patients via reinforcement learning // Artif. Intell. Med. 2014. Vol. 62, N 1. P. 47–60. DOI: https://doi.org/10.1016/j.artmed.2014.07.004
16. Press W.H., Flannery B.P., Teukolsky S.A., VetterlingW.T. Singular value decomposition. § 2.6 // Numerical Recipes in FORTRAN: The Art of Scientifi c Computing. 2nd ed. Cambridge, England : Cambridge University Press, 1992. P. 51–63.
 Высшая школа организации и управления здравоохранением
Высшая школа организации и управления здравоохранением